Manjia Zhao1, Yuntao Dai1*, Qi Li1, Pengyue Li1, Xue-Mei Qin2 and Shilin Chen1*
1 Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing, China, 2 Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan, China
Las saponinas son ingredientes activos importantes. El análisis de las hierbas medicinales que contienen saponinas es un reto en el control de calidad de las hierbas medicinales en las empresas. Tomando el medicamento Astragali radix (AR) como ejemplo, se ha demostrado que los métodos existentes de detección por dispersión de luz evaporativa (ELSD) del astragalósido IV (AG IV) tienen las desventajas de una preparación de la muestra que requiere mucho tiempo y una baja sensibilidad. La universalidad de la ELSD da lugar a una huella dactilar inaplicable con señales enormes de los compuestos primarios y señales más pequeñas de las saponinas. El propósito de este estudio fue proporcionar un método práctico y completo para el control de calidad de los astragalósidos en AR. Se estableció un método sencillo de preparación de muestras con extracción por sonicación e hidrolización con amoníaco, que acorta el tiempo de preparación de unos 2 días a menos de 2 h. Se estableció un método UPLC-QDA con el modo SIM para la cuantificación de AG IV en AR. El extracto de metanol se sometió a UPLC-QDA para el análisis de huellas digitales, y los picos comunes se asignaron simultáneamente con el QDA. Los resultados mostraron que con el nuevo método establecido, el tiempo de preparación de un conjunto de muestras fue inferior a 90 minutos. Las huellas dactilares pueden detectar simultáneamente tanto las saponinas como los flavonoides en la RA. Este método UPLC-QDA simple, rápido y completo es adecuado para la evaluación de la calidad de AR y sus productos en las empresas, y también proporciona referencias para el control de calidad de otros ingredientes de saponina sin absorción UV.
INTRODUCCIÓN
Debido a la complejidad de los ingredientes botánicos, la determinación cuantitativa de los compuestos activos y el análisis holístico de las huellas dactilares se utilizan ampliamente para el control de calidad de los medicamentos a base de plantas (Liu et al., 2007). Sin embargo, las saponinas no producen absorción ultravioleta. El método existente de detección por dispersión de la luz por evaporación (ELSD) se utiliza como detector de propósito general para las saponinas pero con una sensibilidad insuficiente (Qi et al., 2008). El método de HPLC-MS para la determinación de astragalósidos tiene una mejor selectividad y una mayor sensibilidad, pero es relativamente caro y no puede aplicarse ampliamente. El QDA es un detector de masas de cuadrupolo simple y es pequeño y barato en comparación con el ELSD (Veryser et al., 2015; Yao et al., 2016). En la actualidad, los métodos de control de calidad para AR incluyen la determinación del astragalósido IV con HPLC- ELSD. En este método, la preparación de la muestra implica la extracción por reflujo y la separación líquido-líquido con n-butanol, lo que puede llevar más de 2 días por muestra. Además, se intentó establecer huellas dactilares para las saponinas mediante HPLC-ELSD para el control de calidad general de la RA (Ministerio de Salud Pública de la República Popular China, 2015). Sin embargo, la huella dactilar de las saponinas se vio abrumada por picos muy grandes de los componentes primarios, y los picos de las saponinas eran demasiado pequeños debido a la universalidad del método HPLC-ELSD y a la alta proporción de componentes primarios. Por estas razones, el control de calidad de las saponinas requiere mucho tiempo y carece de especificidad o integridad. Por lo tanto, se necesita urgentemente un método de control de calidad sencillo, económico y válido para la RA.
MATERIALES Y MÉTODOS
Preparación de la muestra
Las raíces secas de AR se molieron hasta obtener un polvo homogéneo, y luego se tamizaron a través de una malla Nº 65. Cada muestra de polvo, pesada con precisión (2 g), se colocó en un tubo de centrífuga de 50 mL y se sometió a ultrasonidos (40 kHz, 500 W) con 30 mL de metanol durante 30 min. Después de ser centrifugado (alrededor de 3000 × g) durante 5 min, se filtró la solución de metanol. El residuo se lavó dos veces con 15 mL de metanol, se sometió a ultrasonidos (40 kHz, 500 W) durante 5 min, se centrifugó (aproximadamente 3000 × g) durante 5 min y se filtró. El filtrado se combinó y se evaporó con un evaporador rotatorio, y luego el residuo se redisolvió en 10 mL de solución de amoníaco al 10% (V/V), se agitó de vez en cuando durante 10 min, se filtró a través de un filtro de membrana (0,22 μm), y luego se inyectó en el HPLC.
Condiciones de UPLC-QDA
El análisis cromatográfico se realizó en un sistema Waters ACQUITY H-Class UPLC, equipado con un gestor de disolventes cuaternarios, un gestor de muestras, una aguja de flujo, un calentador de columna de alta temperatura con precalentamiento activo y un detector QDA. La separación cromatográfica se realizó a 35◦C en una columna BEH Shield RP18 (2,1 mm × 100 mm, 1,7 μm) (Waters). La fase móvil consistió en acetonitrilo fórmico al 0,1 % (A) y agua con ácido fórmico al 0,1 % (B), utilizando una elución en gradiente del 5 al 30 % de A a los 0-3 min, del 30 al 40 % de A a los 3-5 min, del 40 al 100 % de A a los 5-15 min y del 100 al 5 % de A a los 15-18 min. El volumen de muestra inyectado fue de 2,5 μL, y el caudal fue de 0,4 mL/min. Las condiciones de la fuente de ionización por electrospray (ESI) fueron las siguientes: ESI en modo positivo; voltaje del capilar, 800 V; fragmentador, 15 V; frecuencia de muestreo, 5 Hz; temperatura de la sonda 500◦C. El ginsenósido Rg1 se detectó en modo SIM 823,48 Da [M+Na]+ a 0-5,5 min; el AG IV y el AG III se detectaron en modo SIM 808,00 Da [M+Na]+ a 5,5-8 min; el AG II y el iAG II se detectaron en SIM 849. 50 Da [M+Na]+ a 0-8 min; AG I se detectó en el modo SIM 869.50 Da [M+H]+ a 0-8 min; iAG I se detectó en el modo SIM 891.50 Da [M+Na]+ a 0-8 min.
Condiciones de HPLC-ELSD
El análisis cuantitativo se realizó utilizando una HPLC de la serie 1200 (Agilent)-ELSD (Alltech 2000 ES). Se utilizó una columna YMC-Triart C18 (250 mm × 4,6 mm. D.S-5 μm) para las separaciones cromatográficas. La fase móvil consistió en acetonitrilo fórmico al 0,1% (A) y agua con ácido fórmico al 0,1% (B), utilizando una elución en gradiente de 5-10% A a 0-5 min, 10-32% A a 5-10 min, 32-45% A a 10-30 min, 45-95% A a 30-35 min, y 95-20% A a 35-40 min. El volumen de inyección fue de 20 μL, y la velocidad de flujo fue de 1 mL/min. La ELSD se realizó con aire como gas portador a un flujo de 2,5 L/min, y la temperatura del nebulizador se ajustó a 100◦C.
RESULTADOS Y DISCUSIÓN Optimización de los sistemas UPLC
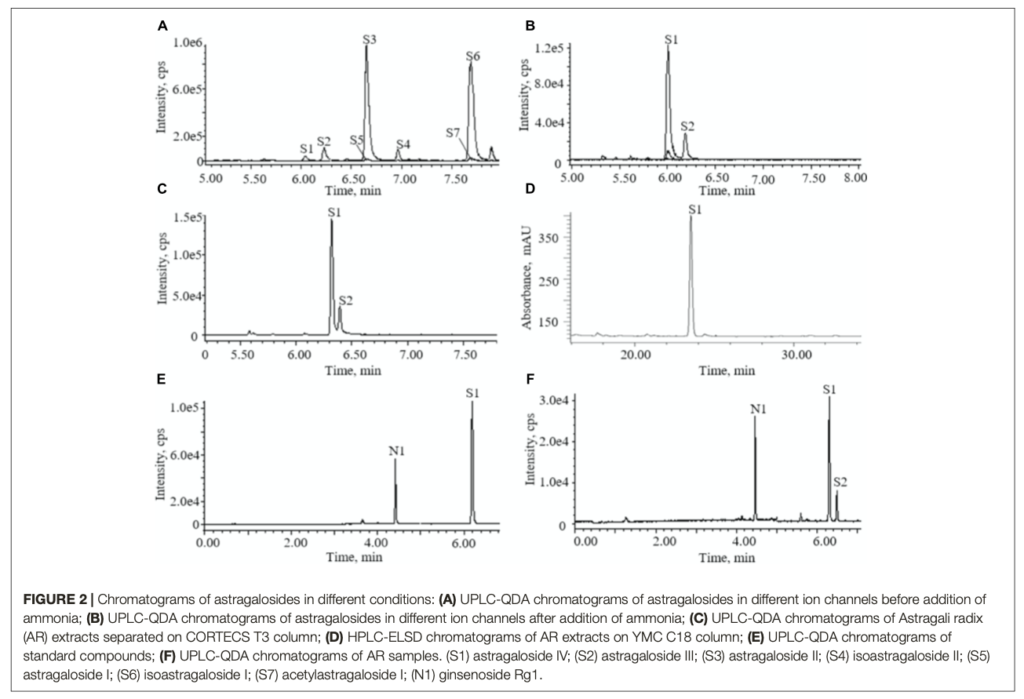
De acuerdo con la literatura, se utilizó acetonitrilo-agua con 0,1% de ácido fórmico como fase móvil (Qi et al., 2009). Se seleccionaron dos columnas como fase fija para la determinación de AG IV en los extractos de AR. La figura 2 muestra los cromatogramas de iones totales (TIC) de ESI (+) para los extractos de AR separados en diferentes columnas. El AG IV y el AG III no se separaron en una columna CORTECS T3, mientras que se logró una buena separación con una columna BEH Shield RP18 (Figura 2). Se utilizó un gradiente de elución para la determinación de AG IV. Para evitar la interferencia de otros compuestos, el gradiente de elución se fijó para comenzar con un 5-30% de disolvente orgánico durante 3 minutos antes de la elución de los compuestos objetivo. Un espectro UV mostró que la mayoría de los compuestos flavonoides se eluyeron antes del pico de AG IV. El gradiente de elución se optimizó para asegurar que la elución de la mayoría de los compuestos altamente polares tuviera lugar antes de la elución del AG IV, evitando el impacto de otros compuestos en la determinación del AG IV.
Optimización de la preparación de la muestra
La preparación de la muestra de AR en los métodos de determinación de AG IV en la farmacopea china incluye la extracción sólido-líquido de 4 horas, la separación líquido-líquido con butanol, que lleva más de 1 día, y el enriquecimiento en columna (Ministerio de Salud Pública de la República Popular China, 2015). La preparación de una muestra tarda más de 2 días, lo que no es adecuado para controlar un gran número de productos en una situación comercial. En este estudio, se utilizaron métodos de extracción por sonicación, en lugar de la extracción por reflujo. Tras la extracción, se añadió una solución de amoníaco a los extractos y se compararon las cantidades de amoníaco. Los resultados mostraron que el área del pico de AG IV aumentaba con la cantidad de solución de amoníaco, alcanzando sus valores más altos con 10 mL o más de solución de amoníaco al 10% (V/V); por lo tanto, en este estudio se utilizaron 10 mL de solución de amoníaco al 10% (V/V). Un paso importante para la preparación de la muestra en la farmacopea china era la extracción inversa con amoníaco. Se ha demostrado que el propósito de este paso era transformar otras saponinas en AG IV (Chu et al., 2014). Se registraron los cromatogramas de los astragalósidos en diferentes canales iónicos antes y después de la adición del tratamiento con amoníaco acuoso (Figura 2). Mostraron que las saponinas detectables en el extracto de metanol de AR eran AG IV (S1) y otros astragalósidos, incluyendo AG II (S3), iAG II (S4), AG I (S5) y iAG I (S6). Después de ser procesados con amoníaco, el AG II (S3), el iAG II (S4), el AG I (S5) y el iAG I (S6) desaparecieron y se transformaron en AG IV (S1) (Chu et al., 2014). Los resultados indicaron que otros astragalósidos, excepto el AG III, podían convertirse en AG IV, y que la cantidad de AG IV detectada era principalmente la suma de AG I (S5), iAG I, AG II (S3) y AG IV (S1).
Optimización de las condiciones UPLC-QDA
El gradiente de elución se optimizó para lograr una buena separación para cada pico en un tiempo corto. Se probaron varios gradientes diferentes y finalmente se seleccionó el gradiente utilizado en este estudio, con una buena separación de cada pico.
Validación del método de huellas dactilares
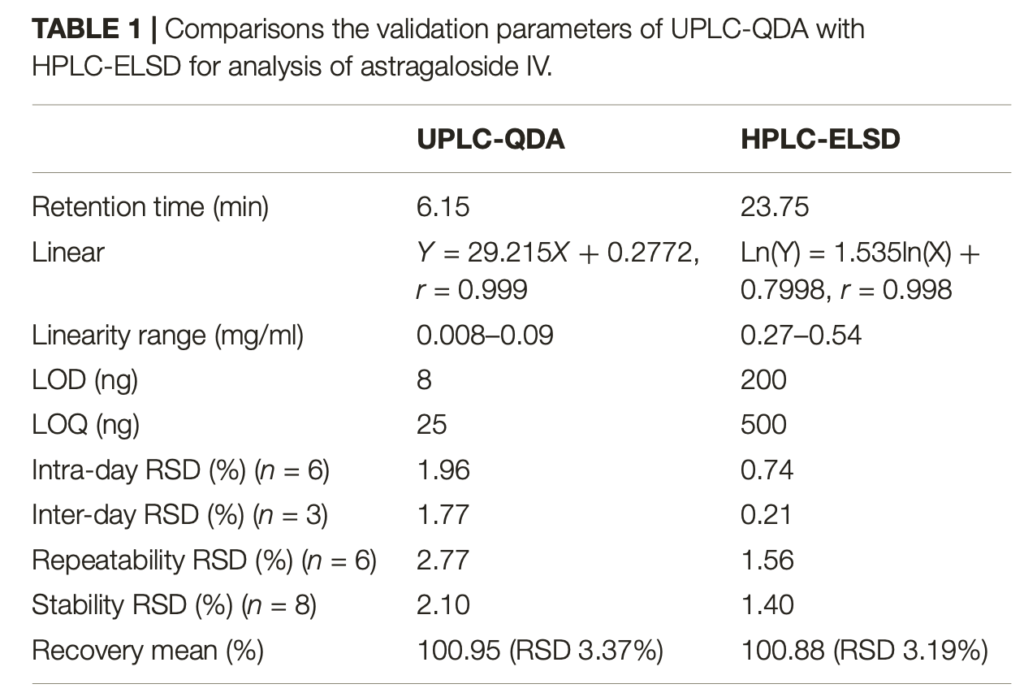
Se calcularon los coeficientes de correlación y el RSD% del RRT y RPA de los picos comunes (Tablas Suplementarias S3- S5). Los coeficientes de correlación de la precisión fueron superiores a 0,989 y el RSD% del RPA fue inferior a 5,00. Los coeficientes de correlación de la prueba de repetibilidad fueron superiores a 0,992 y el RSD% de RPA fue inferior a 8,00. Los coeficientes de correlación de la prueba de estabilidad fueron superiores a 0,984 y el RSD% de RPA fue inferior a 6,10, lo que indica que la muestra permaneció estable durante 1 día. Todas las pruebas de precisión, repetibilidad y estabilidad indicaron que este método era válido y aplicable.
Establecimiento de la huella digital de las saponinas en el AR
En este estudio, se analizaron 15 muestras con el nuevo método desarrollado. El cromatograma medio y los coeficientes de correlación de las muestras se calcularon utilizando el software de similitud, y se descubrió que los coeficientes de correlación de las muestras de RA eran superiores a 0,920, lo que indicaba que todas las muestras analizadas tenían una alta consistencia en la calidad.
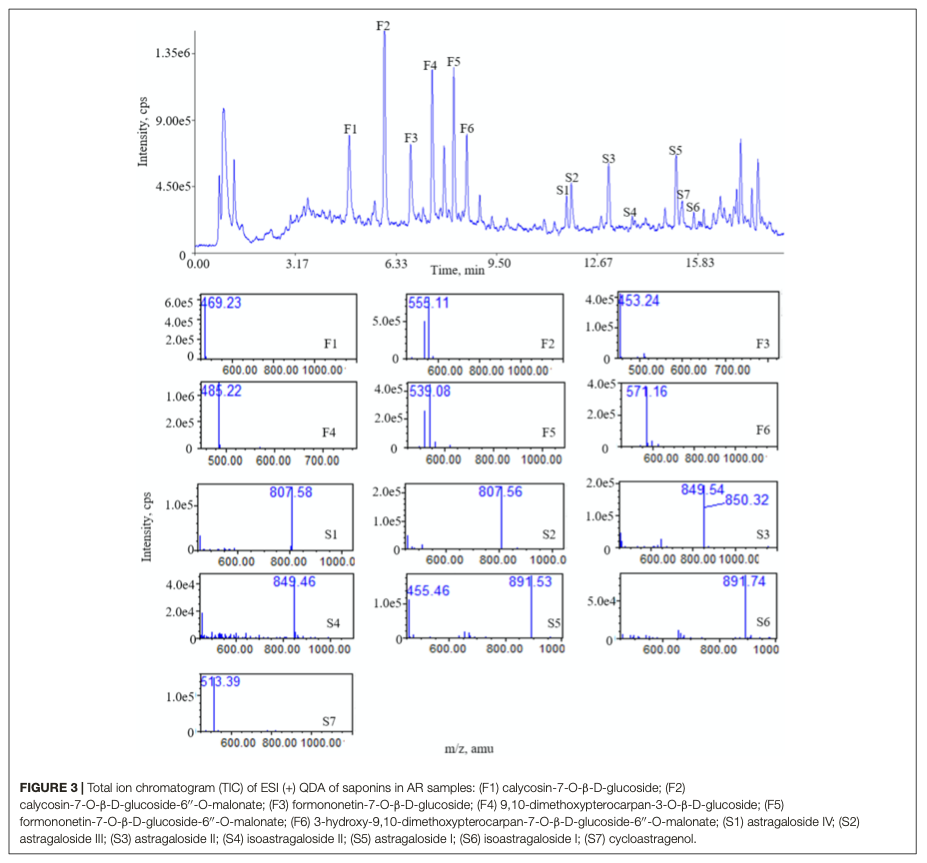
Había 13 “picos comunes” existentes en los cromatogramas de las muestras AR, que se asignaron con masa iónica analizada con QDA y se confirmaron con compuestos de referencia. La figura 3 muestra los espectros de masas típicos de las saponinas. En el modo de iones positivos, seis de las saponinas generaron iones típicos [M+Na]+, con una precisión de masa de 807,5 + 42 n (n = 0 se refiere a AG IV, n = 1 a AG II/iAG II, n = 2 a AG I/iAG I). Los seis picos de los flavonoides generaron iones [M+Na]+ típicos. Los datos de la EM de las seis saponinas y flavonoides en el modo de iones positivos se muestran en la Tabla 3. Se calcularon el RRT y el RPA de los picos comunes en las 15 muestras y los datos del RPA se mostraron en la Tabla Suplementaria S6.
Los resultados muestran que el método de huella digital establecido en este estudio puede detectar simultáneamente una variedad de saponinas y flavonoides. Además, las identidades de cada compuesto pueden establecerse directamente por su número de masa.
CONCLUSIÓN
Se ha establecido un método de cuantificación simple y rápido para el AG IV y una huella digital general de los principales componentes (astragalósidos y flavonoides) en AR con UPLC- QDA. El método establecido fue factible para la evaluación integral de la calidad de la RA. El UPLC-QDA presenta ventajas sobre el ELSD en cuanto a sensibilidad, asignación de picos y detecciones simultáneas de componentes con y sin absorción UV en la huella digital. Los métodos establecidos proporcionan referencias para el control de calidad de los ingredientes de saponina sin absorción UV. Por lo tanto, este estudio proporciona métodos adecuados para la evaluación práctica de la calidad de las saponinas en situaciones comerciales.
Para obtener más información sobre este interesante artículo dirijase a : A Practical Quality Control Method for Saponins Without UV Absorption by UPLC-QDA; Zhao M, Dai Y, Li Q, Li P, Qin X-M and Chen S (2018) A Practical Quality Control Method for Saponins Without UV Absorption by UPLC-QDA. Front. Pharmacol. 9:1377. doi: 10.3389/fphar.2018.01377