Por: Margaret MaziarzPaul D. Rainville
Los métodos analíticos validados se transfieren a menudo entre laboratorios y a socios como las CRO y las CMO que están equipados con sistemas de LC de diferentes proveedores. Cuando se transfieren los métodos, el laboratorio receptor debe generar resultados equivalentes para el mismo análisis a fin de garantizar el control de calidad y el cumplimiento de las directrices reglamentarias.1 Además, si se introduce un nuevo instrumento moderno en un laboratorio, también debe ser capaz de replicar todos los atributos de rendimiento del método validado.
La migración de métodos cromatográficos entre diferentes sistemas de LC, especialmente de diferentes fabricantes, puede ser una tarea difícil. A menudo, estos instrumentos tienen volúmenes de sistema diferentes, lo que puede causar una mala separación cromatográfica y una distorsión de los picos en los métodos de gradiente. Esto puede producir resultados diferentes para el mismo análisis generado a través de los instrumentos.
En este trabajo, se presenta la migración de un método de HPLC para el análisis de sustancias relacionadas del API de la aspirina a un sistema de HPLC Arc. El rendimiento equivalente se demuestra examinando la separación cromatográfica, los resultados de idoneidad del sistema y los resultados del ensayo de sustancias relacionadas. Se demuestra que el sistema Arc HPLC reproduce con éxito los métodos, produciendo una separación cromatográfica y unos resultados analíticos generados por el método equivalentes a los obtenidos en los sistemas LC comparables.
El sistema Arc HPLC es un instrumento moderno, robusto, fiable y reproducible, adecuado para las pruebas de rutina que puede replicar los métodos de HPLC establecidos.2
Experimental
Descripción de la muestra
Mezcla estándar de aspirina e impurezas
Se prepararon soluciones madre separadas con sustancias relacionadas y el API de aspirina en diluyente (60:40 agua/acetonitrilo con 0,1% de ácido fórmico) a 1,0 y 5,0 mg/mL, respectivamente. La solución madre del API se diluyó con diluyente a 0,1 mg/mL y se le añadieron las sustancias relacionadas a un nivel del 10%.
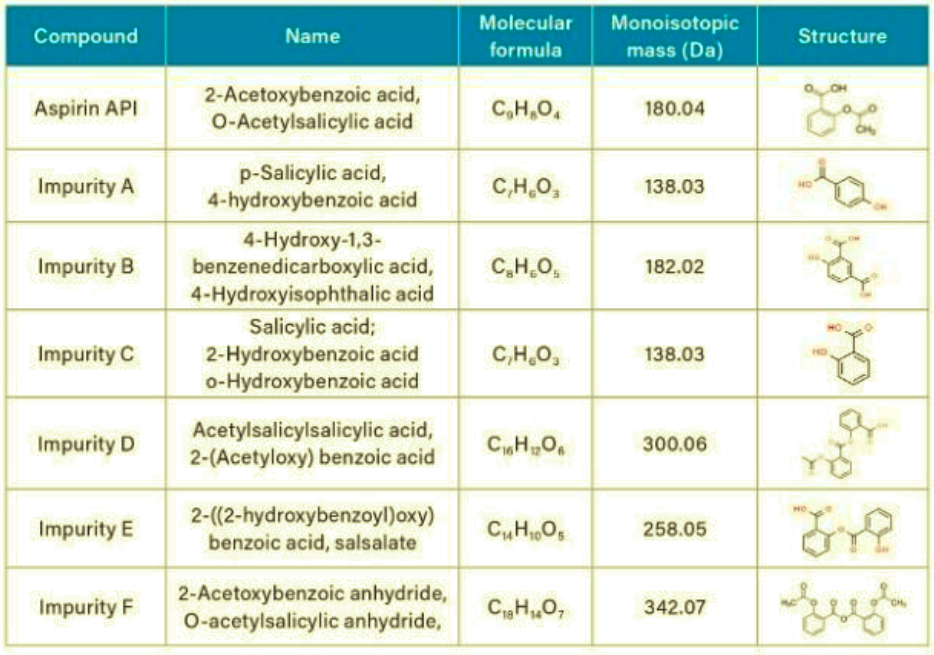
La aspirina y sus sustancias relacionadas especificadas por la Farmacopea Europea3 se enumeran en la Tabla 1
Comprimidos de aspirina
Los comprimidos triturados se disolvieron en diluyente (60:40 agua/acetonitrilo con 0,1% de ácido fórmico) a 1,6 mg/mL de aspirina mediante sonicación durante 10 minutos. Después de la extracción, las soluciones de prueba de las muestras se centrifugaron durante 10 minutos a 3000 rpm y se diluyeron a 0,5 mg/mL con diluyente. Las soluciones se filtraron a través de un filtro de jeringa de nylon de 0,2 µm (Waters p/n# WAT200524) antes del análisis
Condiciones
Sistemas de LC:
Sistema LC Agilent 1260 Infinity II con detector DAD
Sistema HPLC Alliance e2695 con detector PDA 2998, calentador/enfriador de columna con precalentador pasivo
Sistema HPLC Arc con detector PDA 2998, calentador/enfriador de columna con precalentador pasivo
Viales: LCMS Volumen de máxima recuperación de 2 mL, (p/n 600000670CV)
Columna(s): XSelect HSS T3, 4,6 x 150 mm, 3,5 µm (p/n 186004786)
Temperatura de la columna: 40 °C
Temperatura de la muestra: 10 °C
Volumen de inyección: 15 µL
Fase móvil: A: ácido fórmico al 0,1% en agua; B: ácido fórmico al 0,1% en acetonitrilo
Disolventes de lavado: Lavado de purga/muestra: 60:40 agua/acetonitrilo; Lavado de sellado: 90:10 agua/acetonitrilo
Ajustes del detector: PDA: 210-400 nm (derivado a 237 nm)
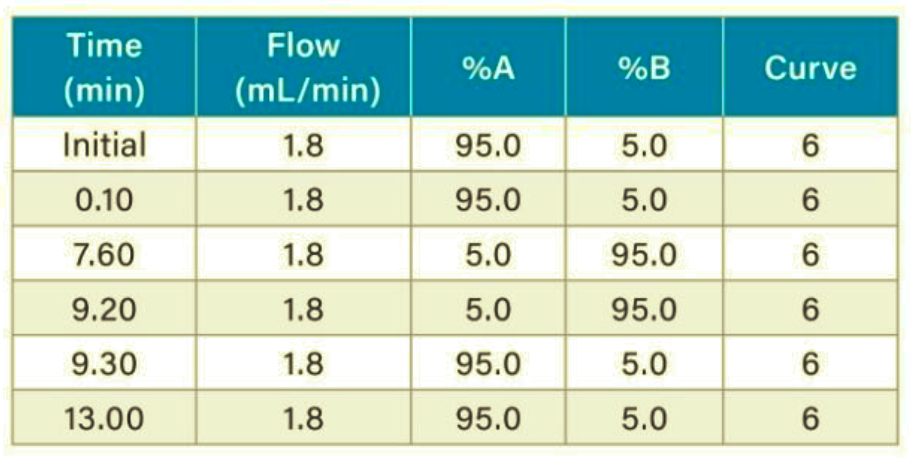
Gradiente
Software
Software de datos cromatográficos (CDS): Empower 3 FR4 SR2
Resultados y discusión
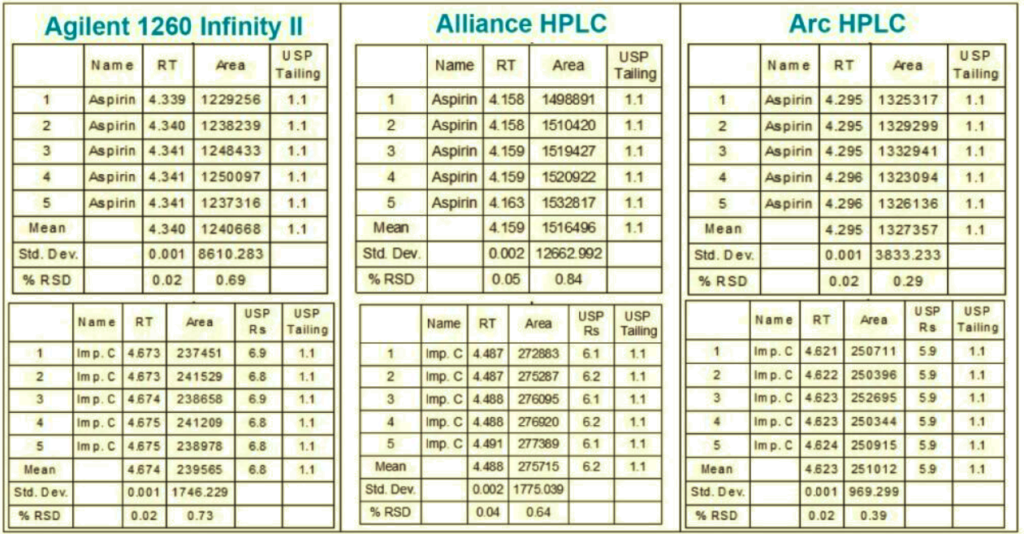
El análisis de la aspirina y sus sustancias asociadas se realizó en condiciones compatibles con la EM, basándose en un método desarrollado previamente.4 El método se escaló a una columna de tamaño de partícula de 3,5 µm utilizando la calculadora de columnas5 y se ejecutó en los sistemas HPLC Agilent 1260 Infinity II, Alliance e2695 y Arc. La separación cromatográfica producida en el sistema Arc HPLC fue comparable con los datos de los sistemas Agilent y Alliance HPLC (Figura 1). El sistema Arc HPLC dio como resultado una resolución USP de ≥5,8 para entre todos los analitos, una cola de pico de 1,1-1,2, y un factor de retentividad ≥2,0
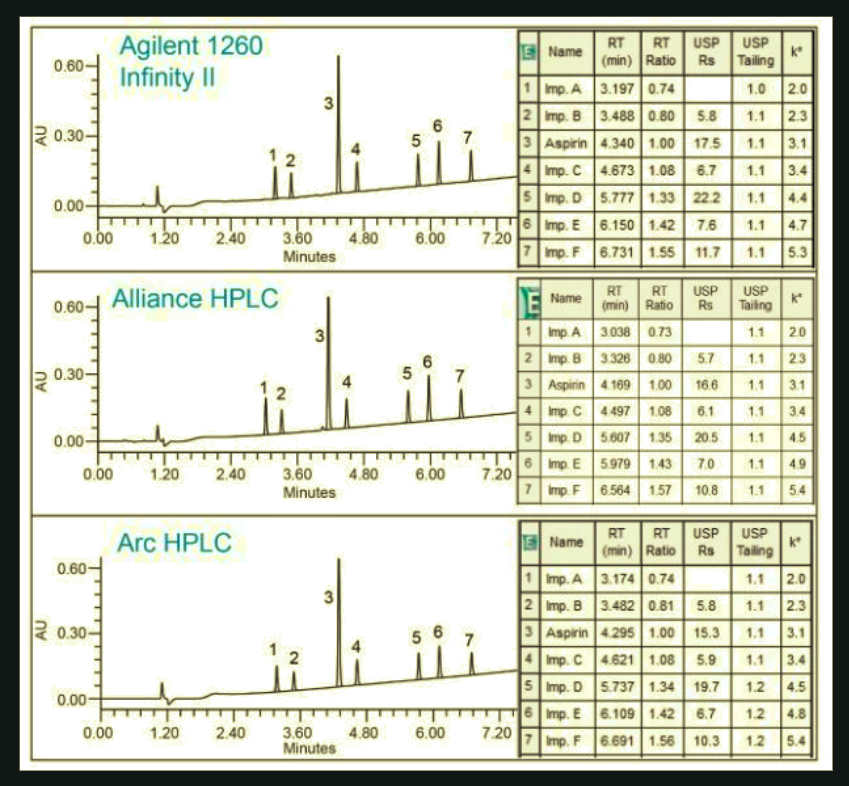
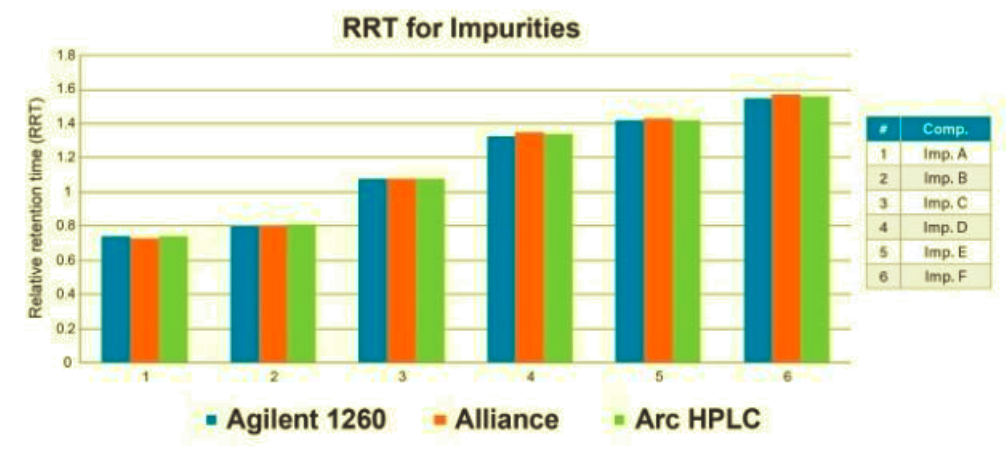
Además, se compararon los tiempos de retención relativos (RRT) de las sustancias relacionadas en todos los sistemas. Los valores de RRT se utilizan a menudo para ayudar a la identificación de los picos en la separación cromatográfica, por lo que es importante que sean los mismos al realizar la transferencia del método de ensayo de sustancias relacionadas en otro sistema. En este estudio, los RRT se calcularon comparando la retención de cada sustancia relacionada con el tiempo de retención de la aspirina. Los datos mostraron que los valores de RRT obtenidos en el sistema Arc HPLC coincidían con los resultados de los sistemas Agilent y Alliance (Figura 2). En general, el sistema Arc HPLC reprodujo con éxito la calidad de la separación cromatográfica sin la alteración del método.
El rendimiento del método en el sistema Arc HPLC se evaluó midiendo la idoneidad del sistema de cinco inyecciones replicadas de la mezcla estándar siguiendo los requisitos enumerados en la monografía de la USP para las tabletas de aspirina5 y se comparó con otros sistemas. Los requisitos de idoneidad del sistema de la USP incluían:
Resolución: no menos de (NLT) 2,0 entre el ácido salicílico (impureza C) y la aspirina
Desviación estándar relativa (RSD): no más de (NMT) 4,0%, ácido salicílico (impureza C)
Los resultados de idoneidad del sistema generados en los tres sistemas cumplieron los criterios de la USP (Figura 3). Además, la RSD de las áreas de pico y los tiempos de retención de la impureza C generados en el sistema Arc HPLC fue inferior al requisito de la USP de NMT 4,0% y a los resultados adquiridos en los otros sistemas de LC.
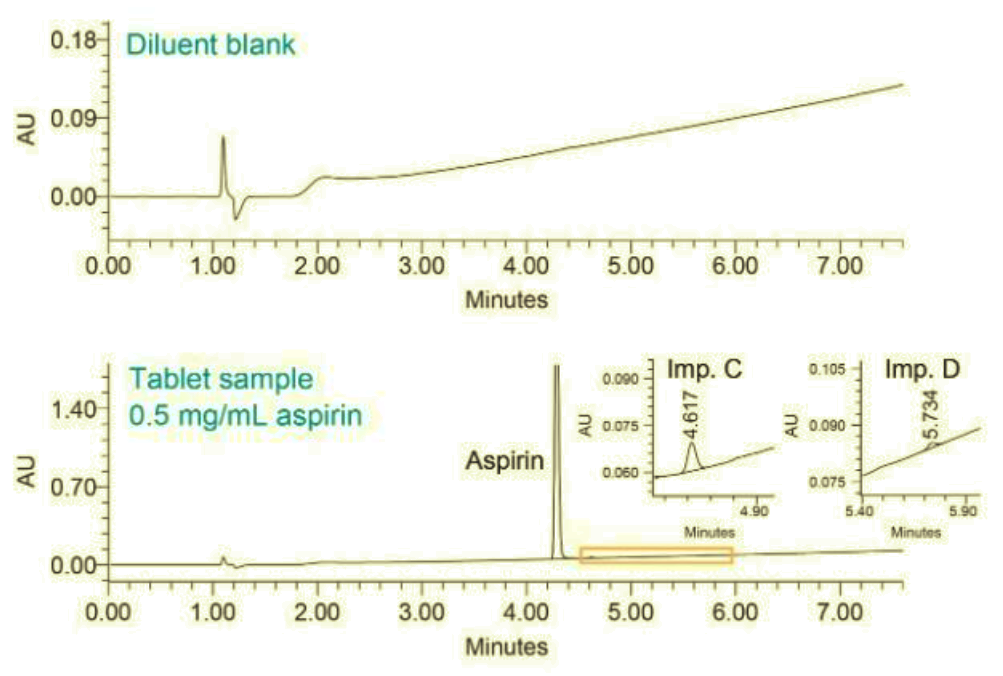
Resultados del ensayo de sustancias relacionadas
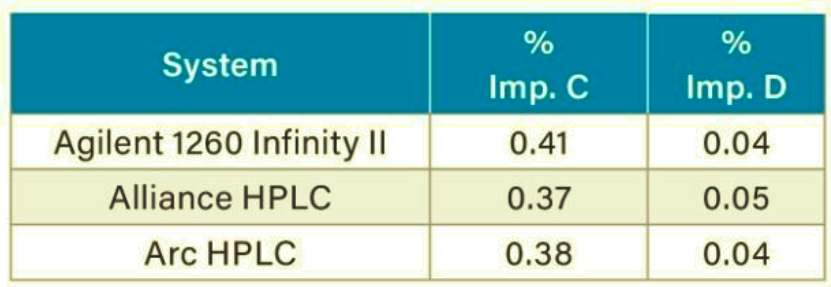
El ensayo del contenido de sustancias relacionadas (% de impureza) se determinó comparando las áreas de pico de cada sustancia relacionada con el área de pico de la aspirina. En la Figura 4 se muestra un ejemplo de los datos cromatográficos del análisis de la solución de muestra del comprimido en HPLC Arc. Los resultados del ensayo se compararon con los criterios especificados en el procedimiento de impurezas de la monografía de la USP para los comprimidos de aspirina.5 Los criterios de aceptación de la USP para las impurezas en los comprimidos recubiertos incluyen no más del (NMT) 3,0% de ácido salicílico (impureza C). Los resultados de las sustancias relacionadas generados en los sistemas HPLC Agilent 1260, Alliance y Arc cumplieron los criterios de la USP (Tabla 2).
Conclusión
El sistema Arc HPLC reprodujo con éxito el método de ensayo de las sustancias relacionadas con el principio activo de la aspirina ejecutado en los sistemas HPLC Agilent 1260 Infinity II y Alliance. La separación cromatográfica, los valores de los tiempos de retención relativos, la idoneidad del sistema y los resultados del ensayo de sustancias relacionadas producidos en el sistema Arc HPLC cumplieron los criterios de aceptación.
En general, el sistema Arc HPLC acepta y replica fácilmente los métodos de LC existentes de una variedad de plataformas, produciendo resultados de ensayo equivalentes sin comprometer la integridad del método. Esto elimina la necesidad de cambiar y revalidar los métodos existentes y sigue cumpliendo las directrices normativas, ya que la sustitución de activos no requiere ningún ajuste que pueda considerarse un cambio de método. El Arc HPLC es un instrumento moderno que ofrece un potente rendimiento, una alta precisión de inyección, un bajo arrastre y una alta tolerancia a la contrapresión.
Referencias
- USP General Chapter (1224), Transfer of Analytical Procedures. United States Pharmacopeia USP 43-NF 38, official prior 2013.
- Arc HPLC System. https://www.waters.com/waters/en_US/Arc-HPLC-System/nav.htm?locale=en_US&cid=135068659.
- Ph. Eur. Monograph. Acetylsalicyclic Acid. The European Pharmacopeia 10.0. 01/2017:0309.
- Maziarz M, Rainville P, Tran Pham. Development of a Robust Method for Analysis of Aspirin and Related Substances Using a Statistical Software and Quality-by-Design Approach. Waters Application Note 720007177EN. 2021.
- Waters Columns Calculator. https://www.waters.com/waters/support.htm?lid=134891632&lcid=134891631&type=DWNL.
- USP Monograph for Aspirin Tablets. United States Pharmacopeia USP 43-NF 38, official 1 May 2020.
Tomado de: https://www.waters.com/nextgen/us/en/library/application-notes/2021/seamless-method-transfer-and-migration-between-instruments-replicating-an-aspirin-and-related-substances-method-on-an-arc-hplc-system.html?xcid=sm-post_20076&utm_content=sf149366550&utm_medium=sf&utm_source=linkedin&utm_campaign=Waters%20Corporation&sf149366550=1